L'hème oxygénase (HO) est une oxydoréductase qui catalyse la réaction :
- hème 3 accepteurs réduits 3 O2 biliverdine Fe2 CO 3 accepteurs d'électrons oxydés 3 H2O.
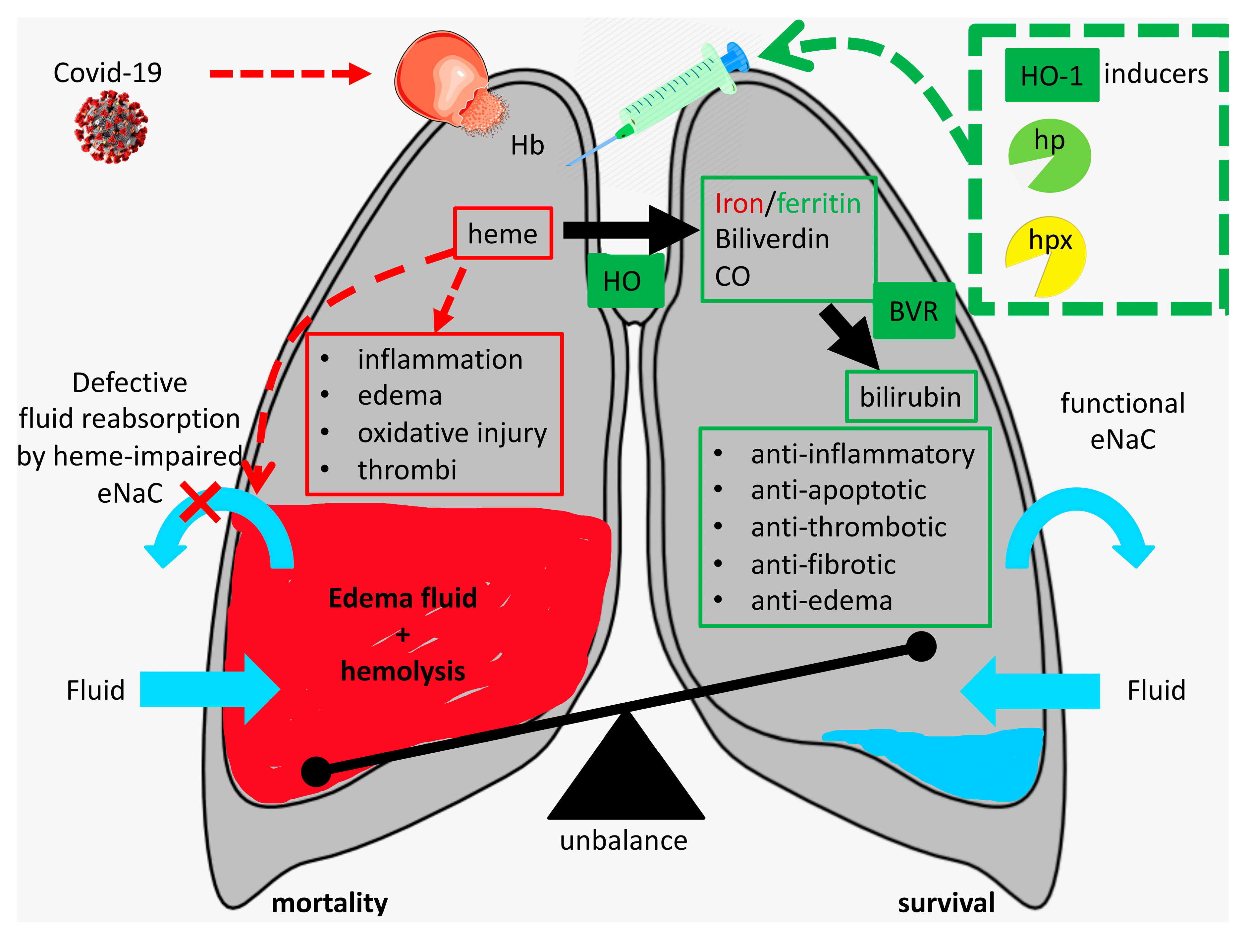
Cette enzyme intervient dans la dégradation de l'hème ; ses produits de dégradation sont la biliverdine, un cation de fer Fe2 et le monoxyde de carbone CO,. Elle scinde le noyau de l'hème au niveau d'un pont alpha-méthène pour donner une molécule de biliverdine (ou de verdoglobine si la molécule d'hème est associée à une globine). La biliverdine est ensuite convertie en bilirubine par la biliverdine réductase.
Cette réaction s'observe lors de la formation d'ecchymoses avec les différents changements de couleur, le rouge est dû à l'hème, le vert à la biliverdine, et le jaune à la bilirubine. Dans les conditions physiologiques normales, l'activité de l'hème oxygénase est très importante au niveau de la rate, lorsque les vieux érythrocytes sont séquestrés et détruits.
Isoformes
Il existe trois isoformes de l'hème oxygénase.
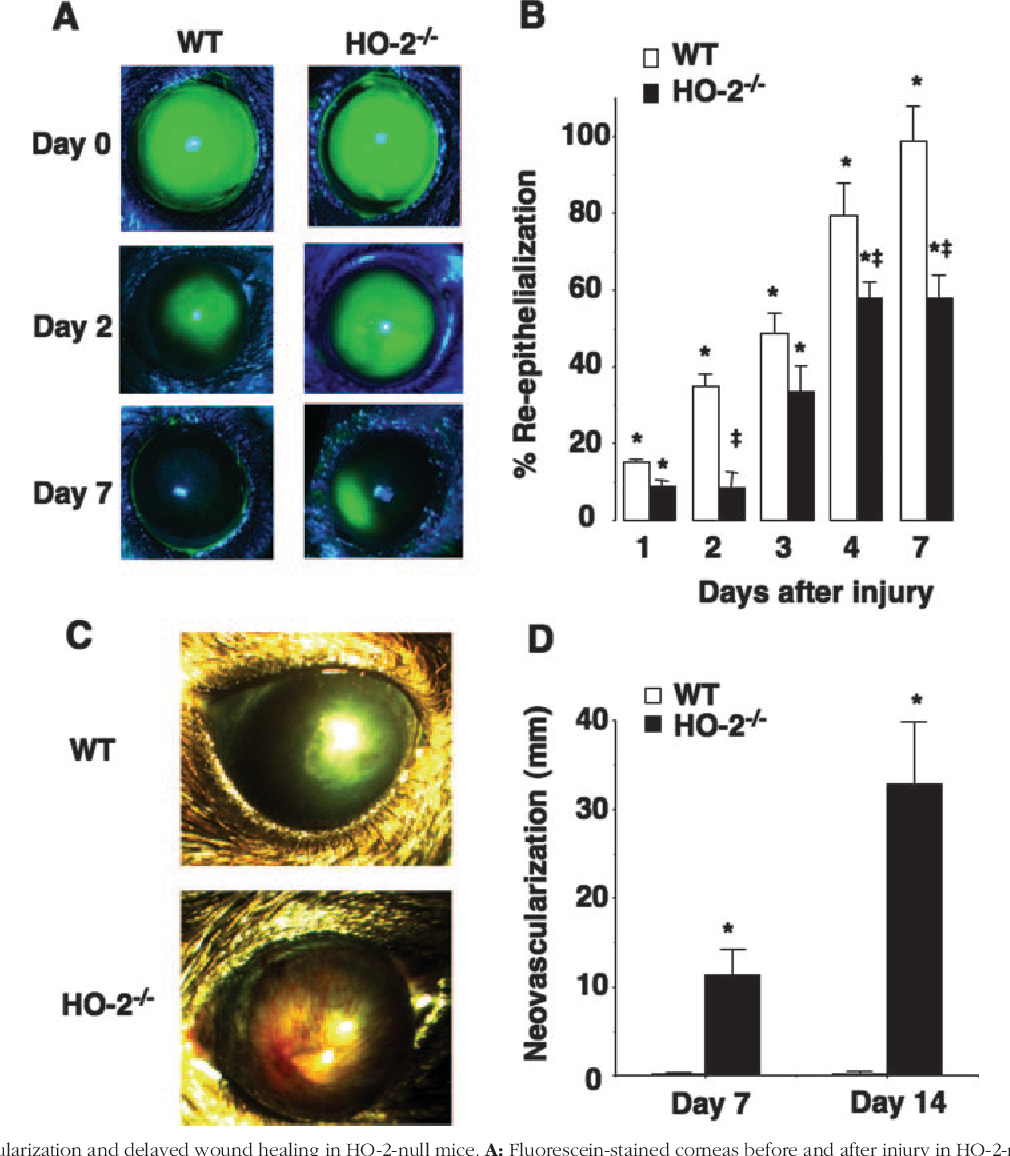
L'hème oxygénase 1 (HO-1) est l'isoforme induit en réponse à divers stress (hypoxie, cytokines…). L'hème oxygenase 2 (HO-2) est l'isoforme constitutif exprimé dans les conditions normales d'homéostasie. Il existe un troisième isoforme, l'hème oxygenase 3 (HO-3) sans activité catalytique propre.
Notes et références
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire